项目文章Gut Microbes(IF 12.2)| 瑞金医院利用多组学揭示肠道微生物群通过肠-脑轴影响阿尔茨海默病的分子机制
- 看不见的线
- 4122
- 2024-06-07 13:55:56
- 文章来源:中科新生命蛋白代谢多组学
已有大量研究描述了肠道微生物群通过肠-脑轴对阿尔茨海默病(AD)患者的大脑产生显著影响。然而,肠道微生物群参与AD发展分子机制的理解仍然有限。目前大多数研究仅关注粪便和血液中代谢物丰度的改变和相关性,而对AD脑内代谢物空间分布、基因表达水平与病理变化等相关特征的研究依然缺乏。
2023年11月,上海交通大学医学院附属瑞金医院汤荟冬/江旭峰/张淼教授合作在Gut Microbes(IF 12.2)上发表题为“Multi-omics data reveals aberrant gut microbiota-host glycerophospholipid metabolism in association with neuroinflammation in APP/PS1 mice”的文章,该研究不仅利用16S rRNA基因测序和代谢组学探讨了AD小鼠肠道微生物丰度和血清代谢丰度的变化特征,还结合空间代谢组学、转录组学、神经影像学和病理学研究了大脑的变化并确定了它们间的相关性。该研究为阐明AD中微生物群-肠-脑轴的机制提供了更直接的证据。中科新生命为该研究提供了16S rRNA测序、非靶向代谢组学、空间代谢组学以及转录组学等技术服务。

研究材料
9月龄APP/PS1小鼠(AD模型),野生型小鼠为对照组,收集粪便、血清样本、脑组织
技术路线
步骤1:使用Morris水迷宫实验测定各组(n=11)的认知水平;
步骤2:采用PET-CT检测小鼠脑内Aβ斑块和神经炎症水平(n=3);
步骤3:收集粪便和血清样本分别进行16S rRNA测序(n=8)和非靶向代谢组学(n=8)分析;
步骤4:脑组织样本进行空间代谢组学(n=3)、免疫荧光(n=6)、转录组(n=3)和qPCR(n=3)分析;
步骤5:整合多组学数据进行相关分析,以探索肠道微生物群与大脑之间的相互作用;
步骤6:选择APP/PS1小鼠(n=6)进行粪便移植(FMT)干预验证多组学结果。
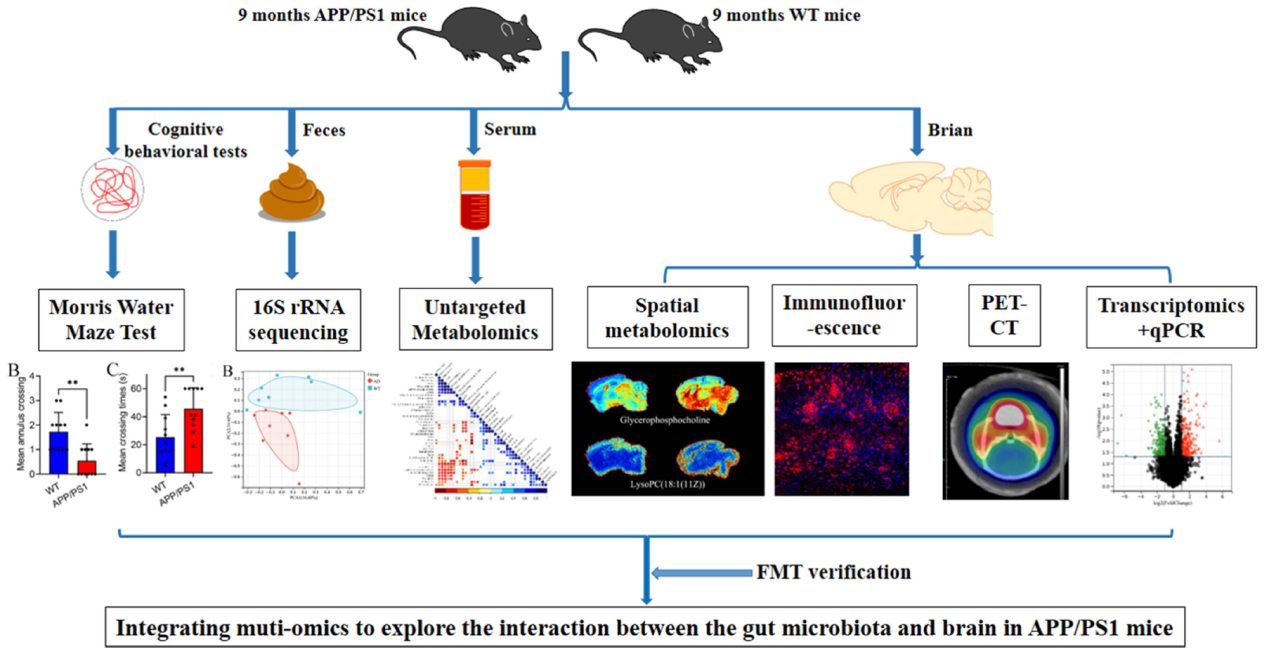
图1实验设计
研究结果
1. APP/PS1小鼠的认知行为和病理特征
使用Morris水迷宫实验检测APP/PS1小鼠和WT小鼠之间认知水平差异,发现APP/PS小鼠组表现出认知障碍。接着采用PET-CT和免疫荧光技术检测两组小鼠脑内Aβ病理水平和神经炎症情况:PET-CT结果显示APP/PS1小鼠大脑中Aβ更高;免疫荧光结果表明APP/PS1小鼠大脑中有显著的Aβ斑块沉积。此外,APP/PS1小鼠组皮质神经元数量低于WT组。这些结果表明APP/PS1小鼠在9月龄时表现出典型的认知障碍和AD病理改变。
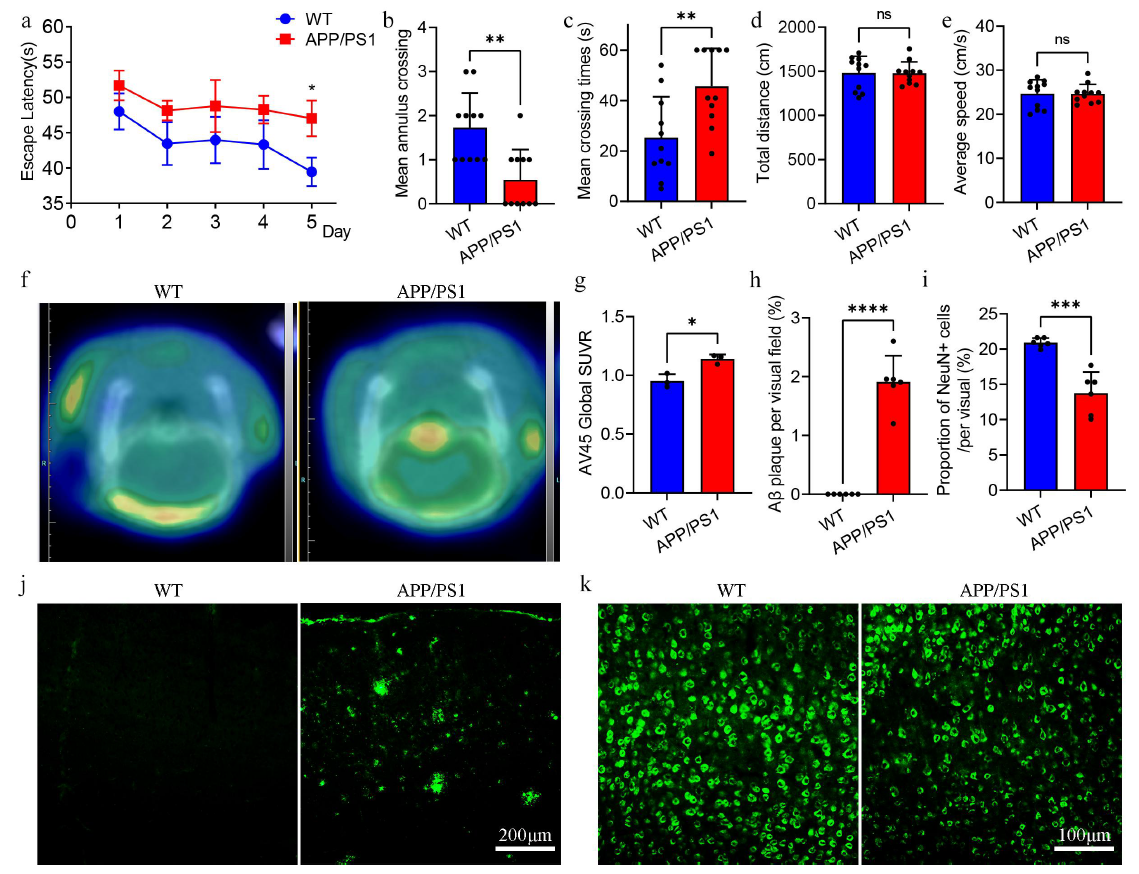
图2APP/PS1小鼠的认知行为和病理特征
2.APP/PS1和WT小鼠肠道微生物丰度的差异
为了研究APP/PS1和WT小鼠肠道微生物丰度的差异,收集两组粪便样本进行16S rRNA检测。Simpson多样性显示两组小鼠肠道微生物群的α多样性没有显著差异,PCoA分析显示两组小鼠之间的β多样性没有显著差异。进一步比较两组小鼠肠道菌群在属水平上的差异,发现APP/PS1小鼠组中脱硫弧菌、肠球菌、图里克氏菌和瘤胃球菌的丰度有所下降,假单胞菌丰度增加。
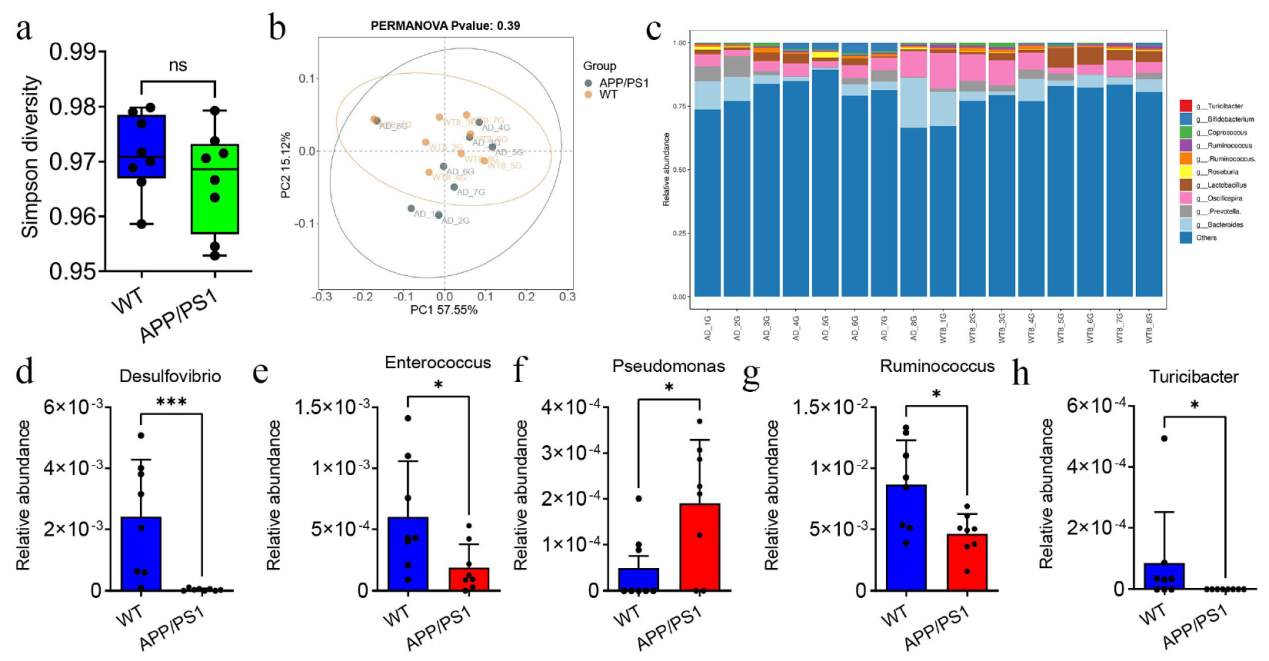
图3APP/PS1和WT小鼠肠道微生物丰度的差异
3.APP/PS1与WT小鼠血清和脑组织代谢物的差异
为了进一步探讨APP/PS1和WT小鼠之间的代谢途径,分别采用非靶向代谢组学和空间代谢组学检测血清和脑组织的代谢变化。PCA分析发现APP/PS1小鼠血清代谢组学与WT小鼠不同,在VIP>1 和p<0.05的筛选阈值下,鉴定到APP/PS1和WT小鼠血清中存在显著差异代谢物有40种,功能富集分析表明这些代谢物在赖氨酸降解、甘油磷脂代谢和嘌呤代谢等途径中富集。此外,基于脑组织空间代谢组学的PCA分析显示APP/PS1和WT小鼠之间的代谢特征存在显著差异,在筛选阈值VIP>1 和p<0.05下,两组之间总共鉴定出28种不同的代谢物,这些代谢物富集在亚油酸和甘油磷脂代谢通路。值得注意的是,甘油磷脂代谢是脑组织和血清中共有的差异代谢途径,由此推测甘油磷脂代谢可能在介导APP/PS1小鼠肠道微生物群与大脑之间的相互作用中发挥关键作用。
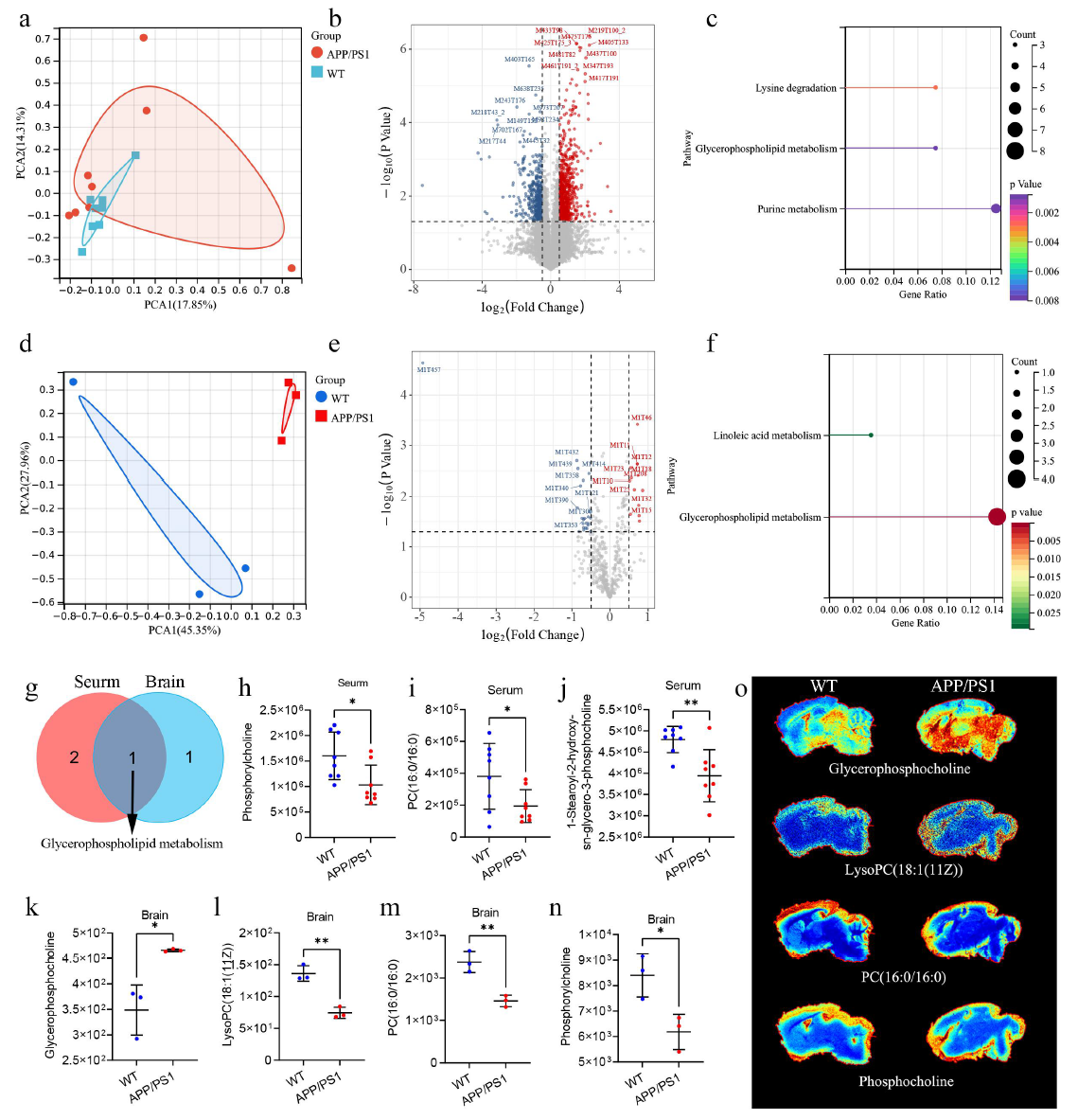
图4 APP/PS1与WT小鼠血清和脑组织代谢物的差异
4.APP/PS1 小鼠中胶质细胞介导的神经炎症和免疫信号通路
已有研究报道AD中神经胶质细胞介导的神经炎症是介导肠道微生物群参与AD进展的重要途径。于是研究者使用PET-CT测量了小鼠大脑中神经炎症的总水平,发现APP/PS1小鼠大脑中神经炎症水平更高。免疫荧光显示APP/PS1小鼠大脑中星形胶质细胞和小胶质细胞明显增殖和激活。进一步采用转录组测序分析小鼠大脑中的基因表达差异,发现在APP/PS1小鼠脑组织中发现269个上调基因和215个下调基因,通路富集分析显示它们主要与趋化因子信号通路、氧化损伤反应、小胶质细胞中的tyrobp因果网络以及小胶质细胞病原体吞噬途径相关。这些结果表明神经胶质细胞介导的免疫信号通路变化是APP/PS1小鼠大脑的一个重要特征。
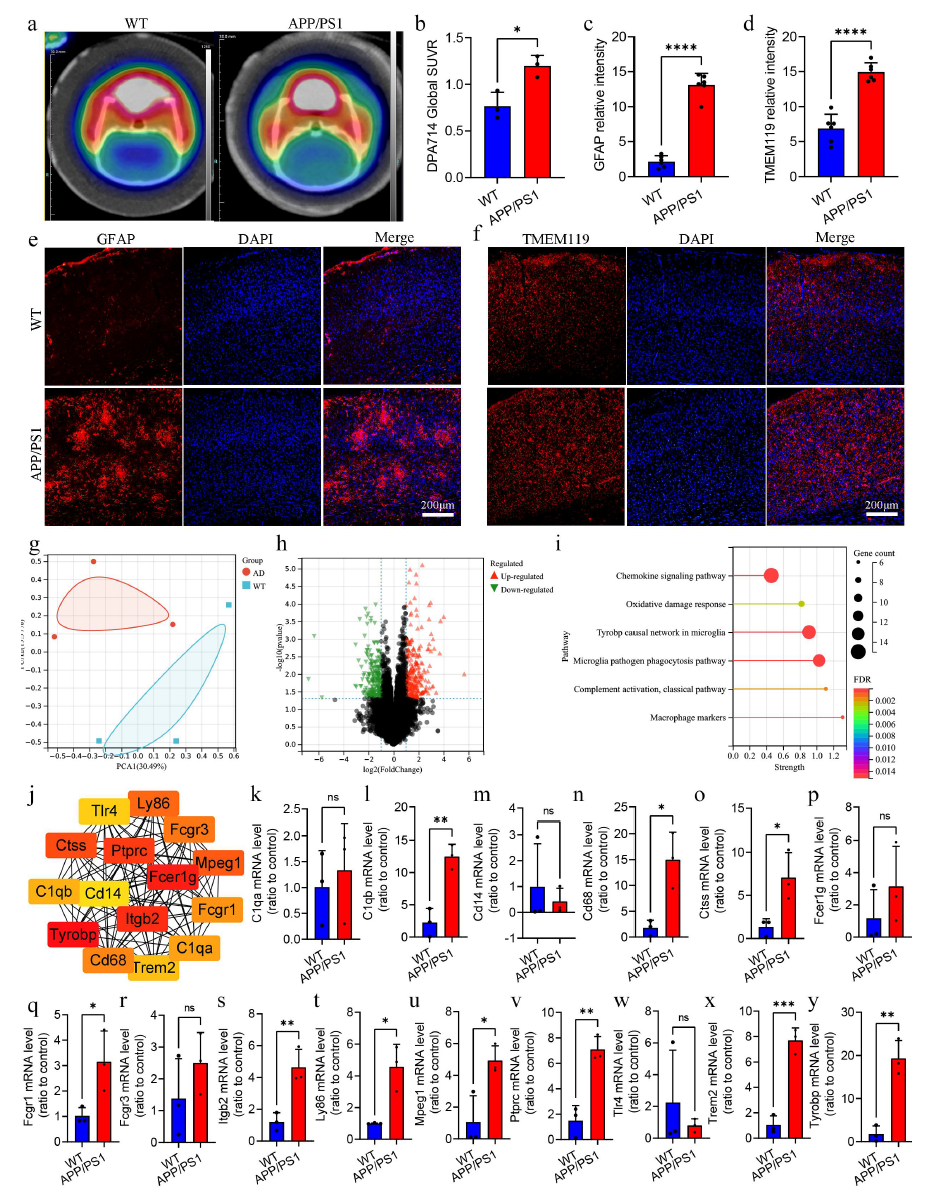
图5APP/PS1 小鼠中胶质细胞介导的神经炎症和免疫信号通路
5.全面分析不同肠道菌群、代谢物和差异表达基因
作者进一步探讨了差异肠道微生物群、代谢物和差异基因表达水平之间的关联。通过对血清中甘油磷脂代谢通路差异代谢物和属水平差异菌群的分析,发现血清中1-硬脂酰-2-羟基-sn-甘油-3-磷酸胆碱水平与假单胞菌丰度呈负相关,磷酸胆碱与脱硫弧菌的丰度呈正相关。通过对大脑中hub差异表达基因与甘油磷脂代谢通路差异代谢物的相关性分析,发现脑内磷酸胆碱、PC(16:0/16:0)、lysoPC(18:1(11Z))水平与Ly86、Ptprc、C1qb、Mpeg1、Tyrobp、Fcgr1、Cd68和Trem2等基因的表达水平呈负相关。
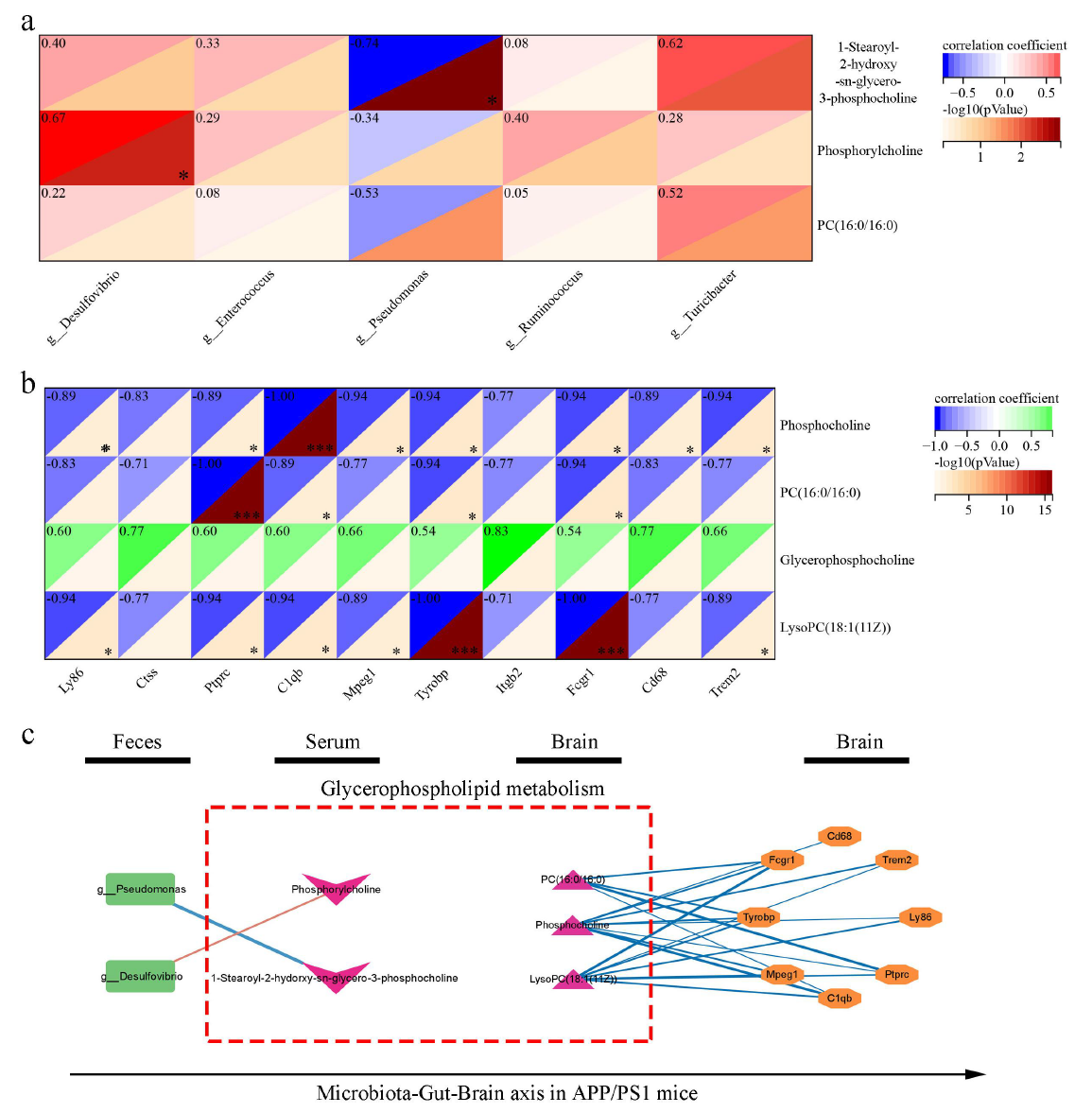
图6全面分析不同肠道菌群、代谢物和差异表达基因
6.FMT 干预调节APP/PS1小鼠的甘油磷脂代谢并改善Aβ病理和神经炎症
最后研究者利用FMT来验证多组学结果,发现FMT干预可以降低APP/PS1小鼠血清中1-硬脂酰-2-羟基-sn-甘油-3-磷酸胆碱和PC(16:0/16:0)水平,而磷酸胆碱水平没有变化,表明FMT干预部分调节了APP/PS1小鼠的甘油磷脂代谢过程。进一步研究发现FMT组大脑中的Aβ斑块减少,星形胶质细胞和小胶质细胞增殖和活化减少,而且FMT干预还可以调节Cd68、Ctss、Fcrg1、Ptprc、Trem2和Tyrobp的表达。这些结果证实了肠道菌群对APP/PS1小鼠甘油磷脂代谢和神经炎症的潜在调节作用。
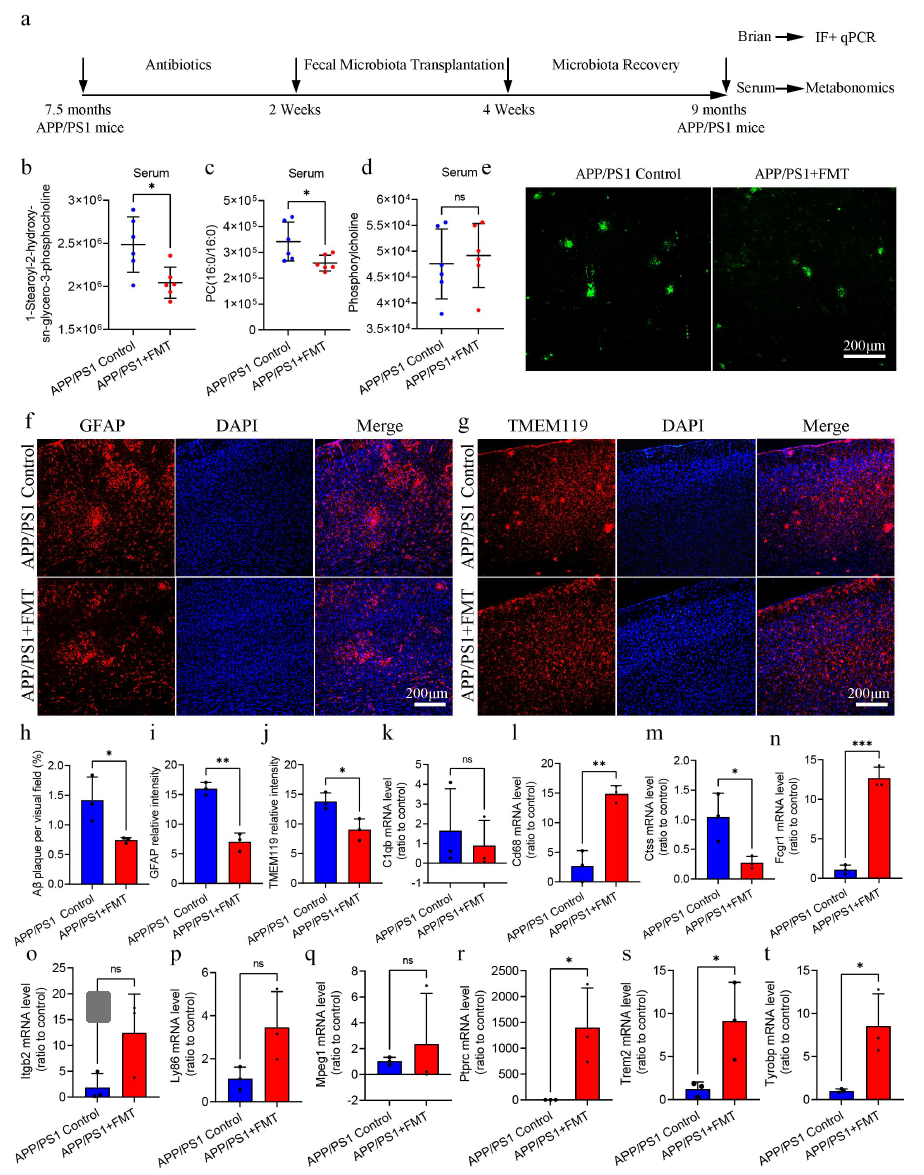
图7FMT干预调节APP/PS1小鼠的甘油磷脂代谢并改善Aβ病理和神经炎症
小结
总的来说,本研究整合多组学(16S rRNA测序和代谢组学、空间代谢组学和转录组学)结果,描述了APP/PS1 AD小鼠模型中肠道微生物群丰度、血清和大脑中的甘油磷脂代谢以及大脑中的神经炎症通路的变化情况,并通过整合分析以及粪便移植(FMT)干预揭示了 APP/PS1小鼠肠道微生物群、宿主甘油磷脂代谢和神经炎症水平之间的潜在关联,本研究促进了我们对于肠道微生物群与AD之间关系的理解。
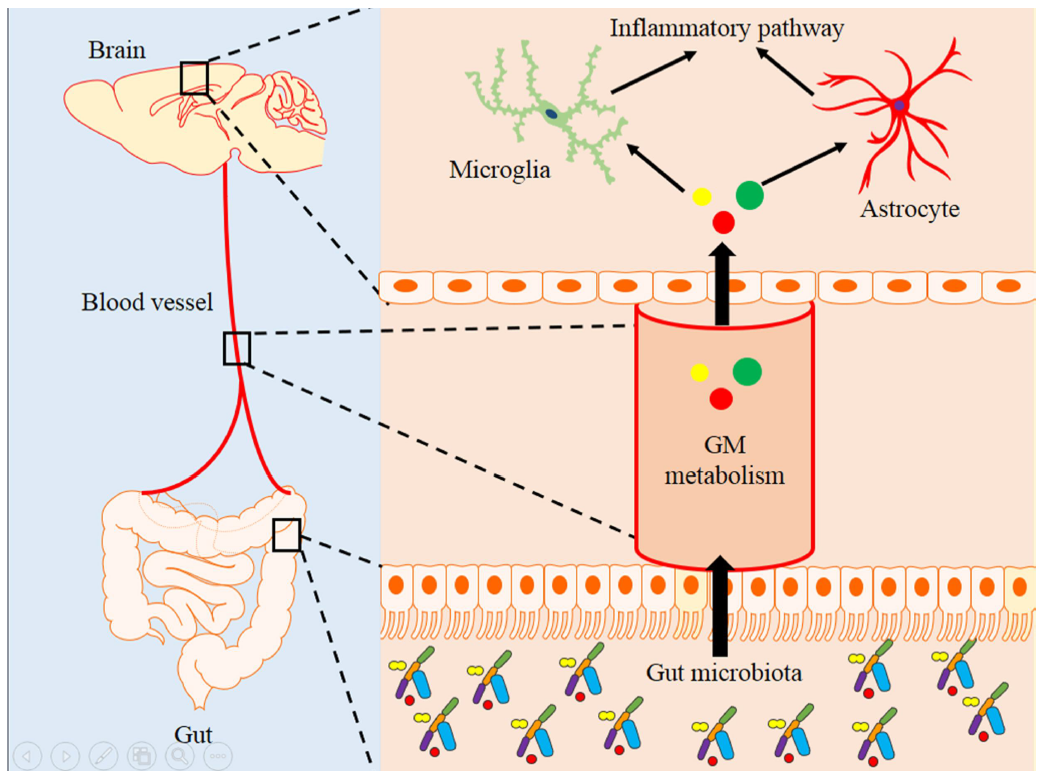
图8作用机制模式图
-
点赞 (0人)
- 收藏 (0人)



