iMeta | 浙江农科院肖英平组揭示肠道微生物影响猪脂肪沉积的作用机制
- 看不见的线
- 6622
- 2024-06-07 14:33:22
- 文章来源:iMeta
丁酸梭菌和碳水化合物活性酶有助于减少猪的脂肪沉积

iMeta主页:http://www.imeta.science
研究论文
●原文链接DOI: https://doi.org/10.1002/imt2.160
●2024年1月3日,美国阿肯色大学赵江潮、浙江省农业科学院杨华、肖英平等团队在iMeta在线联合发表了题为 “Clostridium butyricum and carbohydrate active enzymes contribute to the reduced fat deposition in pigs” 的研究文章。
●本文研究揭示了不同脂肪沉积表型金华猪肠道微生物丁酸梭菌(C. butyricum)和碳水化合物活性酶(CAZymes)功能之间的联系,为深入了解肠道微生物功能与宿主脂肪沉积的关联机制奠定了理论基础。
●第一作者:马灵燕、陶诗煜、宋彤星
●通讯作者:赵江潮(jzhao77@uark.edu)、杨华(yanghua@zaas.ac.cn)、肖英平(xiaoyp@zaas.ac.cn)
●合作作者:吕文涛、李英、汪雯、沈琪辰、倪艳、朱江
●主要单位:浙江省农业科学院、华中农业大学、佛山科学技术学院、浙江儿童医院、阿肯色大学
亮 点
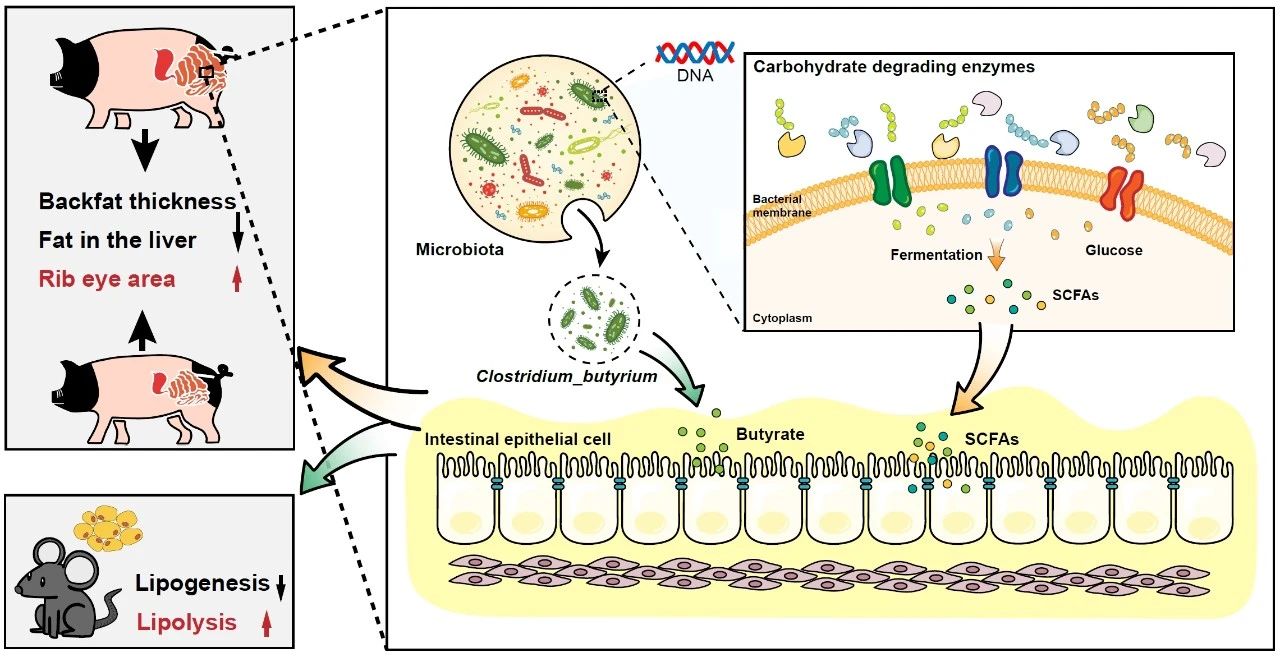
● 不同体脂表型金华猪不同肠段的微生物组成和功能存在显著差异;
● 低体脂金华猪结肠中的短链脂肪酸含量较高,表明其碳水化合物发酵能力更强;
● 丁酸梭菌是低脂肪沉积金华猪的代表性菌种,其基因组中碳水化合物活性酶GH13的比例较高;
● 丁酸梭菌分离株可减缓肥胖小鼠的脂肪沉积并增加肠道微生物中GH13的丰度。
摘 要
猪肠道是一个栖息数万亿微生物的微生态系统,这些微生物能够增强宿主从饲料碳水化合物中提取能量的能力,与宿主脂肪沉积密切相关。然而,导致猪体脂表型差异的微生物及其相关作用机制仍需要进一步研究。在本研究中,我们发现具有不同脂肪沉积表型的金华猪在不同肠段的微生物组成和潜在功能存在显著差异。且脂肪沉积较低的金华猪在结肠中短链脂肪酸含量较高,表明其碳水化合物发酵能力更强。此外,进一步研究了不同脂肪沉积表型金华猪肠道微生物碳水化合物活性酶(CAZymes)表达的变化差异,并揭示了它们在调节脂肪沉积中的作用。我们进一步发现丁酸梭菌(C. butyricum)是低脂肪沉积金华猪的代表性菌种,其基因组中含有较高比例的糖苷水解酶家族13(GH13)。通过小鼠C. butyricum干预试验证实了从实验猪中分离出的C. butyricum能够增强肠道微生物编码GH13的能力,促进碳水化合物发酵,从而减缓宿主脂肪沉积的作用。同时通过饲料中添加C. butyricum的金华猪饲养实验,发现猪肠道微生物组和脂肪沉积发生类似的变化,进一步支持了C. butyricum在调节脂肪沉积方面的潜在作用。综上所述,我们的研究揭示了C. butyricum 和 CAZymes功能之间的联系,为深入了解肠道微生物功能与宿主脂肪沉积的关联机制奠定了理论基础。
视频解读
Bilibili:https://www.bilibili.com/video/BV1DN4y1H75w/
Youtube:https://youtu.be/2vUrOXL4AH0
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
近年来,大量的研究致力于揭示人类肠道微生物组与各种疾病的复杂关系,以及其对代谢、营养、生理和免疫功能的深远影响。猪与人类在解剖学和生理学上的具有高度相似性,使其成为人类疾病建模的有吸引力和可靠的选择。因此,猪肠道微生物组的研究引起了越来越多的关注。猪的胃肠道内孕育着广阔、多样且动态复杂的微生物群落,数万亿与宿主相互作用的共生微生物在其中发挥关键作用,维持代谢稳态。通过猪微生物研究可以深入了解猪的营养、生理、免疫和疾病,进而为人类疾病的研究提供重要借鉴和支持。
过多的脂质积累对人类和动物都构成重大的健康风险。在动物生产中,过度脂肪沉积被认为是影响育肥效率、肉质、繁殖性能和免疫力的重要因素。研究表明,肠道微生物在脂肪沉积中发挥着作用。我们之前的研究证实了不同品种猪的肠道微生物组、脂质储存和猪生长健康之间存在密切联系。鉴于肠道微生物在猪的健康和生产中发挥的关键作用,更好地了解猪微生物群落的功能并挖掘参与脂质沉积的有益细菌菌株至关重要。
地方猪品种对特定环境条件和食物来源表现出高度的适应能力,被视为宝贵的资源。金华猪主要分布在中国浙江省金华地区,是中国著名的本土黑白猪品种,具有生长缓慢和体脂肪含量高等特点。作为一种典型的高体脂沉积类猪品种,金华猪已成为研究脂肪沉积机制的典型模型。然而,导致金华猪不同脂肪沉积差异的微生物群落结构和相关机制仍需全面阐明。本研究旨在探讨具有不同体脂表型金华猪的微生物结构及功能差异,以更好地理解不同代谢类型猪之间脂肪沉积差异的机制,进一步挖掘参与脂质沉积的有益细菌菌株,可为深入了解肠道微生物功能与宿主脂肪沉积的关联机制奠定理论基础。
结 果
实验动物和研究设计
本研究设计了三个动物试验(图1)。在第一个动物试验中,以78头雄性金华猪为研究对象,并进一步选择14头具有极端表型值的金华猪肠道内容物进行16S rRNA和宏基因组测序,以揭示不同脂肪沉积表型金华猪的微生物结构及功能差异。验证试验包括小鼠和猪的丁酸梭菌干预试验。对于小鼠试验,以雄性C57BL/6J小鼠为研究对象,通过高脂饮食诱导小鼠肥胖模型,验证丁酸梭菌分离株对高脂饮食诱导的肥胖小鼠脂肪沉积和肠道微生物的作用。同时,进一步以金华猪为研究对象,通过丁酸梭菌饲喂试验,验证丁酸梭菌对猪体脂沉积的调控作用(图1)。
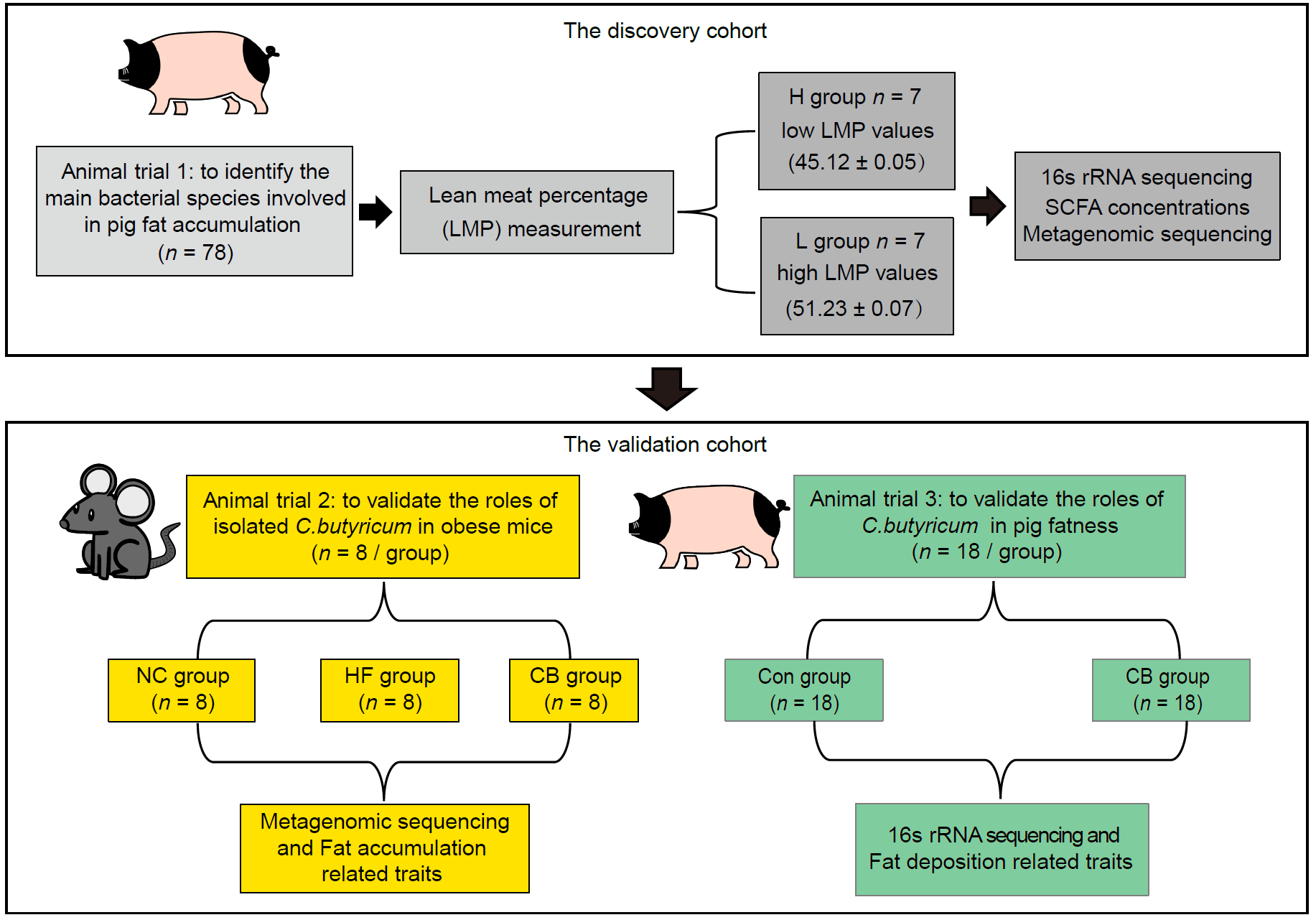
图 1. 实验动物和研究设计的流程图
这项研究涵盖了三个动物试验:第一个猪试验旨在探索肠道微生物组与猪脂肪沉积之间的相关性;第二个小鼠干预试验旨在验证丁酸梭菌分离株在高脂饮食诱导的肥胖小鼠脂肪积累中的作用;第三个猪干预试验则旨在验证丁酸梭菌在调控猪脂肪沉积中的作用。
基于16S rRNA测序探究不同体脂表型猪肠道微生物组成及功能差异
主成分分析(PCA)结果显示,两组猪胃肠道(GI)不同肠段的细菌群落存在显著差异(图2A)。在十二指肠、空肠和回肠中,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)占主导地位,分别占总微生物的70%、10%和约10%以上(图2B)。另一方面,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)在盲肠和结肠中的平均丰度合计超过90%(图2B)。此外,在H组空肠中厚壁菌门(Firmicutes)的相对丰度显著增加(图2B);且十二指肠中变形菌门(Proteobacteria)和肠杆菌(Enterobacteriaceae)的含量较高,而L组盲肠中蓝藻菌(Cyanobacteria)的水平明显减少(图2B)。在属水平上,乳杆菌(Lactobacilli)、韦荣球菌(Veillonella)和特里斯孢菌(Terrisporobacter)在小肠区域(如十二指肠和空肠)更为丰富,而拟杆菌目S24-7组(Bacteroidales S24-7 group)和普雷沃氏菌9(Prevotella 9)在结肠和盲肠中更为丰富(图2C)。更重要是,狭义梭菌属(Clostridium sensu stricto 1)在L组的小肠和大肠段都中显著富集(图2D)。
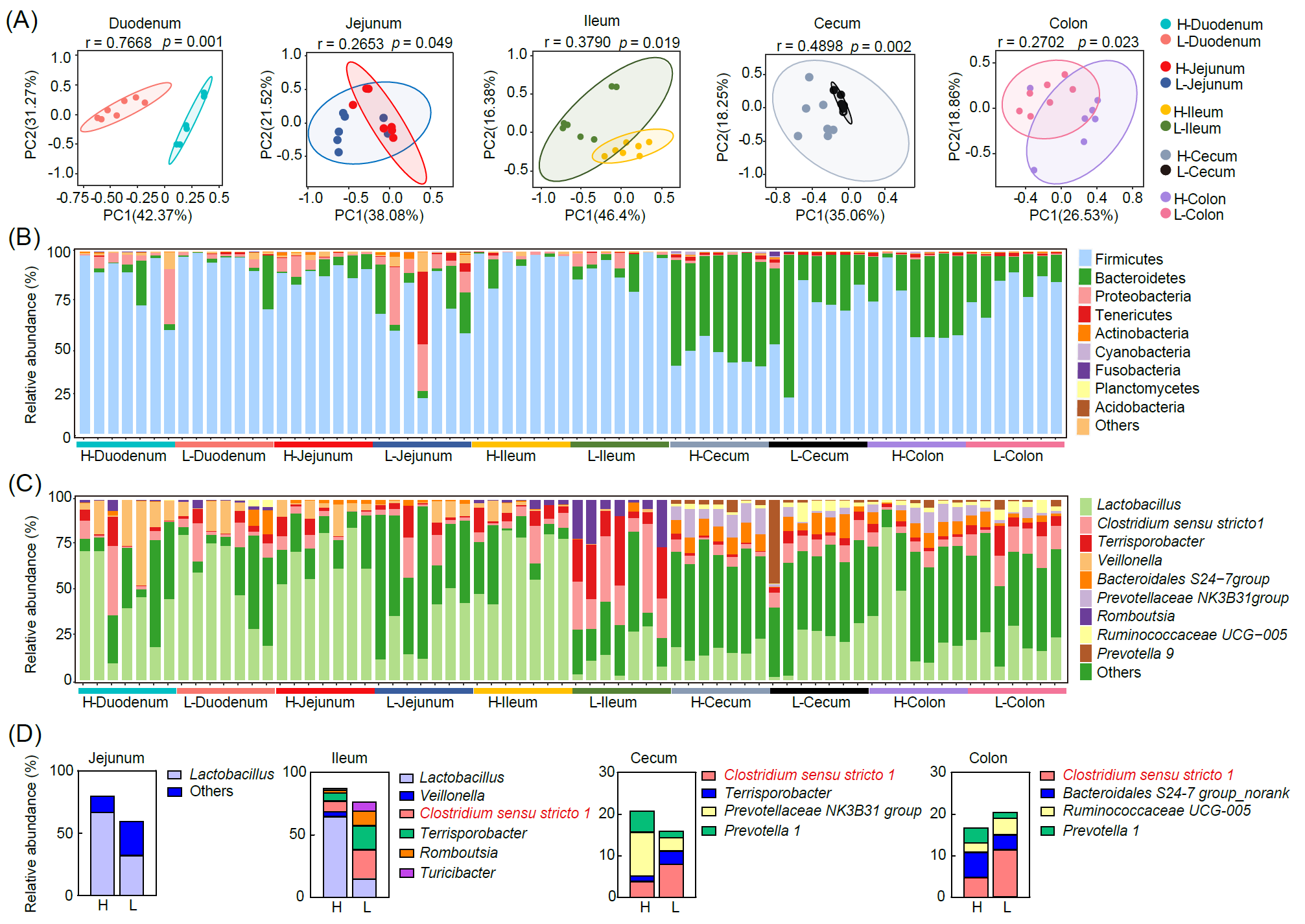
图2. 基于16S rRNA基因测序的肠道微生物分析
(A)基于不同肠段样本微生物群落的主成分分析;(B)门水平微生物组成的相对丰度变化;(C)属水平上微生物组成的相对丰度变化;(D)回肠、盲肠和结肠中特定属菌属差异变化。
基于宏基因组的细菌基因组组装
进一步通过宏基因组深度测序对两组金华猪结肠内容物进行宏基因组组装,共生成了1,288个宏基因组组装基因组(MAGs)。如图3A所示,782个MAG被鉴定为厚壁菌门(Firmicutes),291个属于拟杆菌门(Bacteroidetes),68个属于螺旋体门(Spirochaetes)。此外,64个MAG被鉴定为变形菌门(Proteobacteria),18个被鉴定为广古菌门(Euryarchaeota),只有16个MAG被鉴定为放线菌门(Actinobacteria)。在图A中,L组中富集的MAG主要属于厚壁菌门(Firmicutes),相反,被鉴定为拟杆菌门(Bacteroidetes)的MAG在H组中更为丰富。主坐标分析基于Bray-Curtis和Jaccard距离的结果显示,不同体脂沉积水平的金华猪结肠肠道微生物群具有显著差异(图B)。
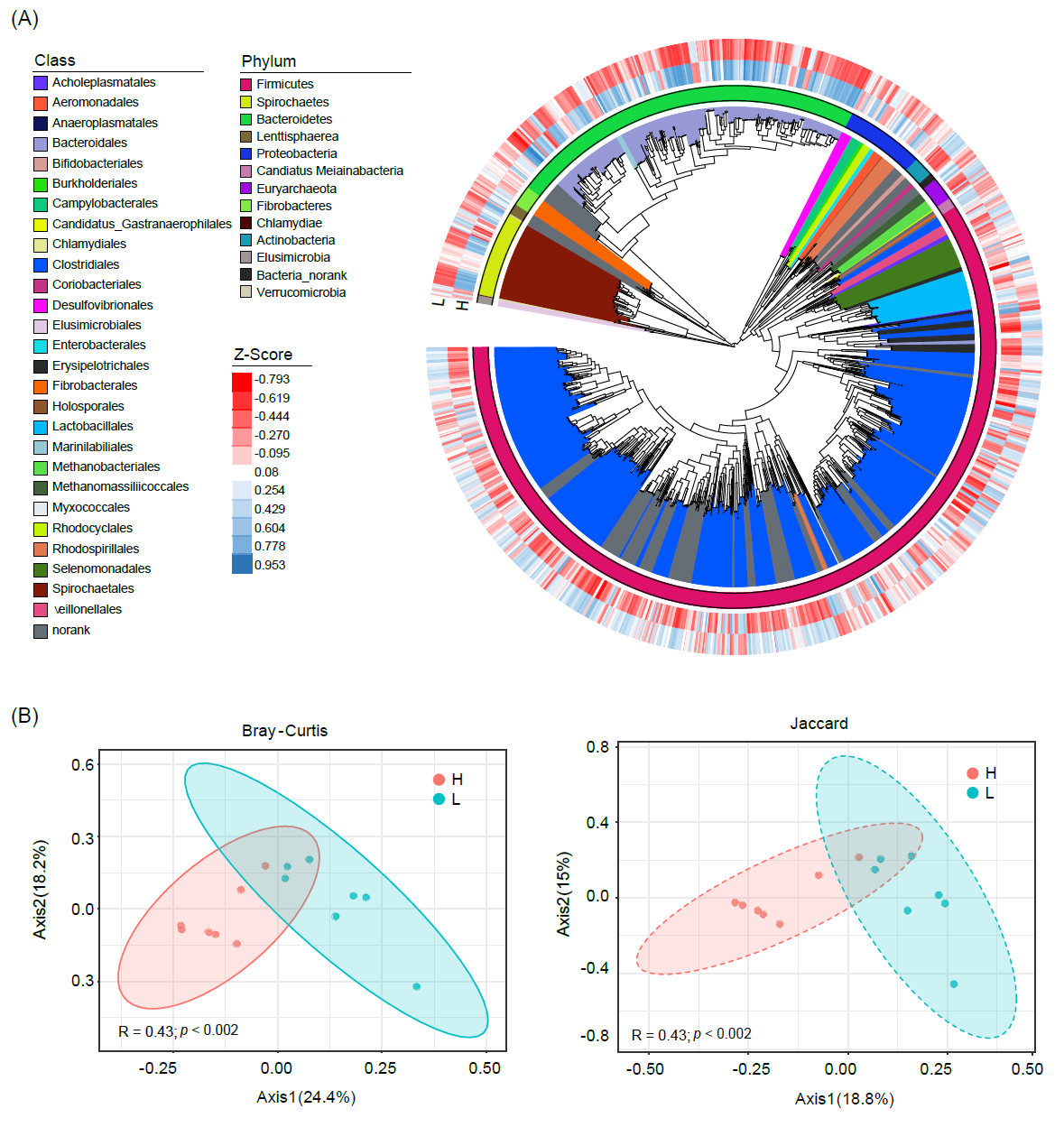
图3. 高体脂组和低体脂组金华猪结肠微生物组宏基因组分析
(A)1,288个宏基因组组装基因组;(B)基于组间 Bray-Curtis 和 Jaccard 距离的主坐标分析图。
基于宏基因组测序解析与脂肪沉积相关的肠道微生物功能变化
如图4所示,L组中的菌群功能主要涉及ABC转运蛋白、磷酸转移酶系统、嘌呤代谢、糖酵解、糖异生、淀粉和蔗糖代谢以及糖脂代谢等途径(图4A);另一方面,高脂肪沉积金华猪肠道菌群功能主要涉及脂肪酸代谢、鞭毛组装、乙醛酸和二羧酸代谢、脂肪酸生物合成、抗生素生物合成、脂多糖生物合成等代谢途径(图4A)。通过相关性分析进一步评估猪的微生物功能变化与体脂表型和短链脂肪酸(SCFAs)之间的关联(图4A)。在L组中,富集的代谢途径主要与体重、平均背膘厚度和肝脏脂肪呈负相关,但与眼肌面积和SCFAs水平呈正相关(图4A)。相比之下,与高体脂沉积相关的代谢途径与眼肌面积和SCFAs水平呈负相关,但与体重、平均背膘厚度和肝脏脂肪呈显著正相关(图4A)。L组在糖酵解/糖异生、淀粉和蔗糖代谢、磷酸转移酶系统、嘧啶代谢和内酰胺抗性方面表现出显著更高的丰度水平。研究发现这些途径与丁酸和异丁酸水平呈正相关(图4A、B)。相反,H组中脂肪酸生物合成增加,与丁酸和异丁酸呈负相关(图4A、B)。
因此,我们深入比较了与淀粉和蔗糖代谢、糖酵解/糖异生以及短链脂肪酸发酵途径相关的KO基因的丰度。数据显示,在L组中,蔗糖磷酸转移酶(scrAB)、果糖激酶(scrK)、葡萄糖-6-磷酸异构酶(GPI)、葡萄糖-6-磷酸1-脱氢酶(G6PD)、多磷酸葡萄糖激酶(PGK)、甘油醛3-磷酸脱氢酶(GAPDH)、糖醇氧化酶(AldO)、磷酸葡萄糖变位酶(PGM)、烯醇化酶(ENO)、二氢硫辛酰胺乙酰转移酶(DLAT)、琥珀酸脱氢酶(SDH)、3-羟酰辅酶A脱氢酶(fadN)和丁酸激酶(Buk)的丰度较高。这些发现为深入理解微生物功能与宿主脂肪代谢之间的复杂关系提供了重要线索,表明在低脂肪沉积金华猪中,肠道微生物促进短链脂肪酸合成相关菌群功能,进一步影响宿主脂肪沉积。
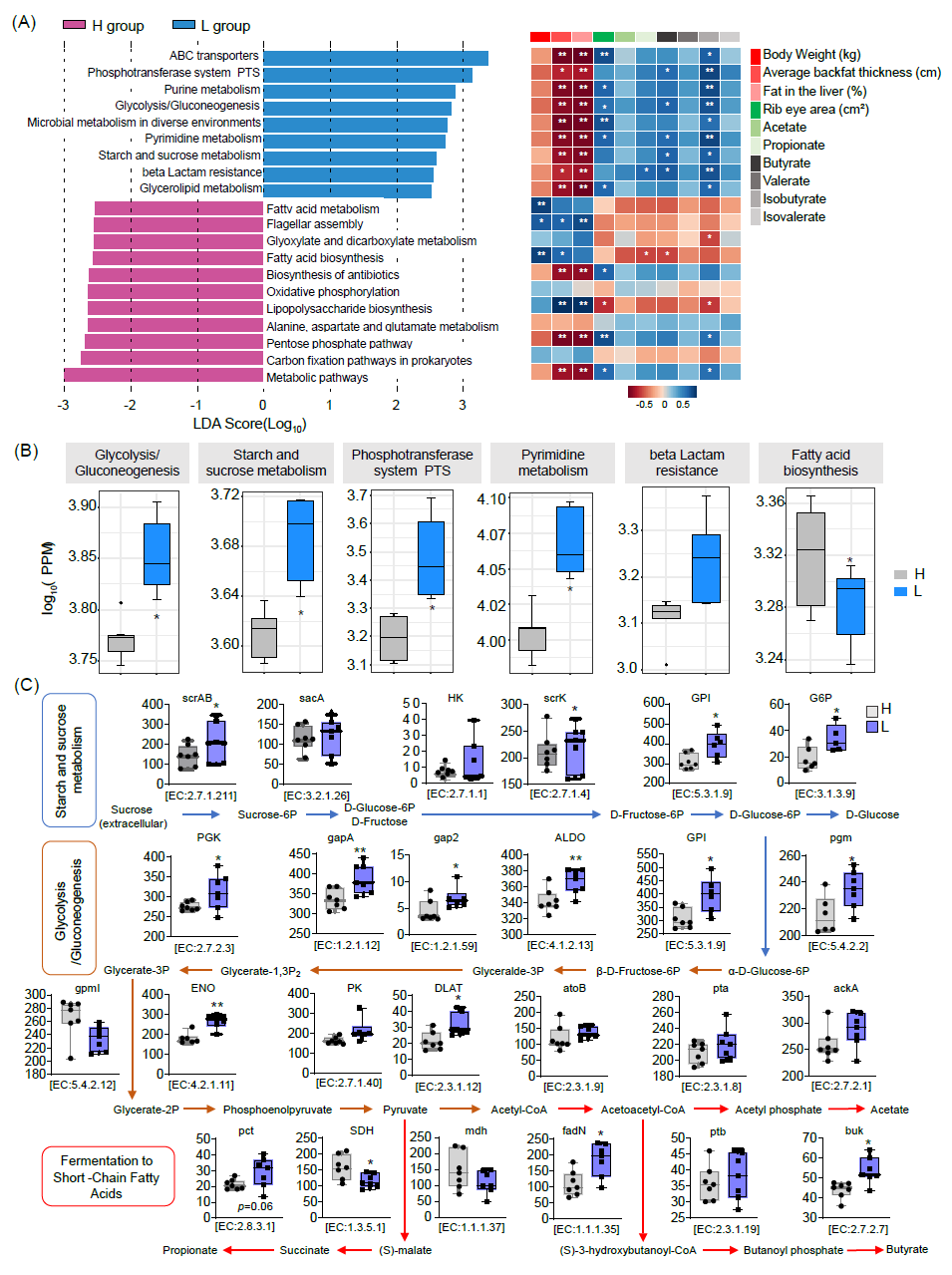
图4. 高体脂组和低体脂组金华猪肠道微生物代谢途径差异分析
(A)KEGG水平 3 上代谢途径差异;(B)与丁酸显著相关的KEGG 功能;(C)参与丁酸和乙酸代谢途径的代表性相关酶。
不同脂肪沉积金华猪肠道微生物中CAZymes比较分析
通过对两组之间CAZymes的差异进行分析,我们发现L组中的CAZymes多样性低于H组(图5A)。PCA进一步表征了两组之间CAZymes水平的显著差异(r = 0.5879,p值= 0.005;图5B)。此外,L组中编码GH和PL的基因丰度较H组显著降低,而编码AA、SLH、粘连蛋白和dockerin的基因丰度更高(图5C、D)。
对两组之间具有显著差异的CAZymes进行进一步分析,发现这些CAZymes家族主要与淀粉、乳糖、果聚糖、粘蛋白、阿拉伯木聚糖、甘露糖、果胶和木聚糖的代谢相关。值得注意的是,L组中富集的CAZymes与SCFAs产量和眼肌面积呈正相关,而与平均背膘厚度和肝脏脂肪呈负相关(图5E、F)。相反,与高脂肪沉积组相关的CAZymes则与这些表型呈负相关(图5F)。这些发现提示微生物介导的CAZymes在调节宿主体脂沉积相关表型中发挥着至关重要的作用。
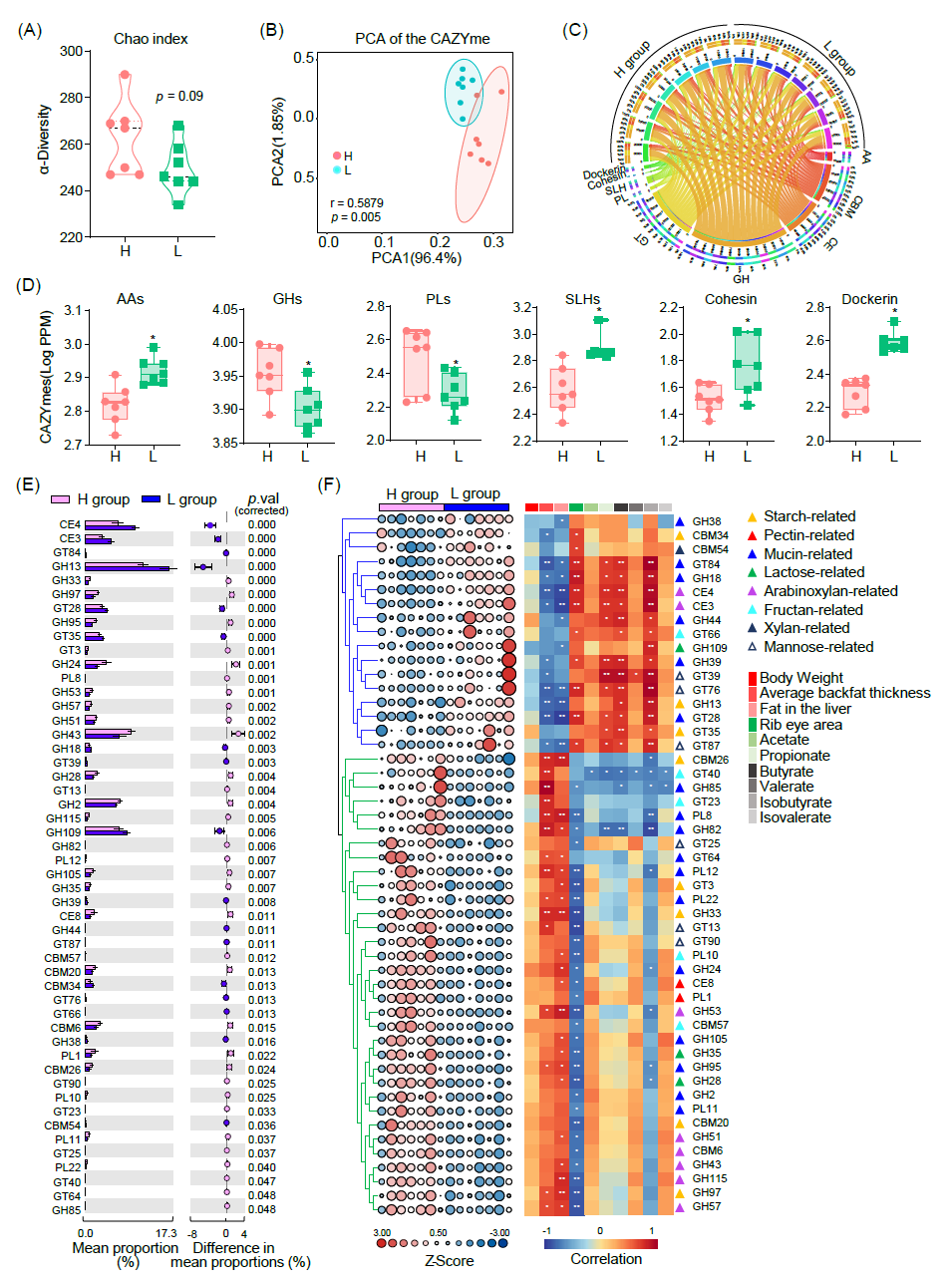
图5. 不同体脂沉积金华猪肠道菌群编码CAZymes的差异表达分析
(A)α多样性;(B)基于使用 Bray-Curtis 距离的主坐标分析;(C)H 组和 L 组之间不同的CAZymes模式;(D)核心CAZymes家族;(E)两组中具有统计学显著性的 CAZymes;(F)CAZymes与SCFAs水平及体脂沉积相关表型之间的相关性。
与脂肪沉积相关的丁酸梭菌菌株鉴别及其CAZymes 基因解析
宏基因组测序结果显示,H组(n = 70 MAG)中富集的MAG数量多于L组(n = 14 MAG)(图6)。在差异富集的MAG中,与丁酸梭菌相关的两种MAG(Bin 314和Bin 375)在L组中变化最为显著(图6)。由于L组中编码GH13酶最为丰富的基因富集,我们进一步研究了CAZymes,特别是GH13在丁酸梭菌基因组中的分布。系统发育分析显示这些基因主要与厚壁菌门(Firmicutes)相关,尤其是梭菌属(Clostridium)。此外,梭状芽胞杆菌CAG:221(Clostridium CAG:221)、马赛梭菌-P2846(Clostridium marseillei-P2846)和丁酸梭菌(C. butyricum),被确定为编码GH13的主要菌株。
鉴于丁酸梭菌是L组中最显著富集的MAG之一,我们提出以下假设:丁酸梭菌可能在宿主脂肪沉积中发挥关键作用。通过对丁酸梭菌基因组中CAZymes的分布进行鉴定,我们发现32.38%的酶是dockerin,25.12%是GH,15.39%是CBM,12.66%是GT,9.74%是CE,2.74%是AA,1.65%为SLH,0.34%为PL。在这些中,CBM50、CE4、GH13和GH1是丁酸梭菌基因组中最丰富的CAZymes。
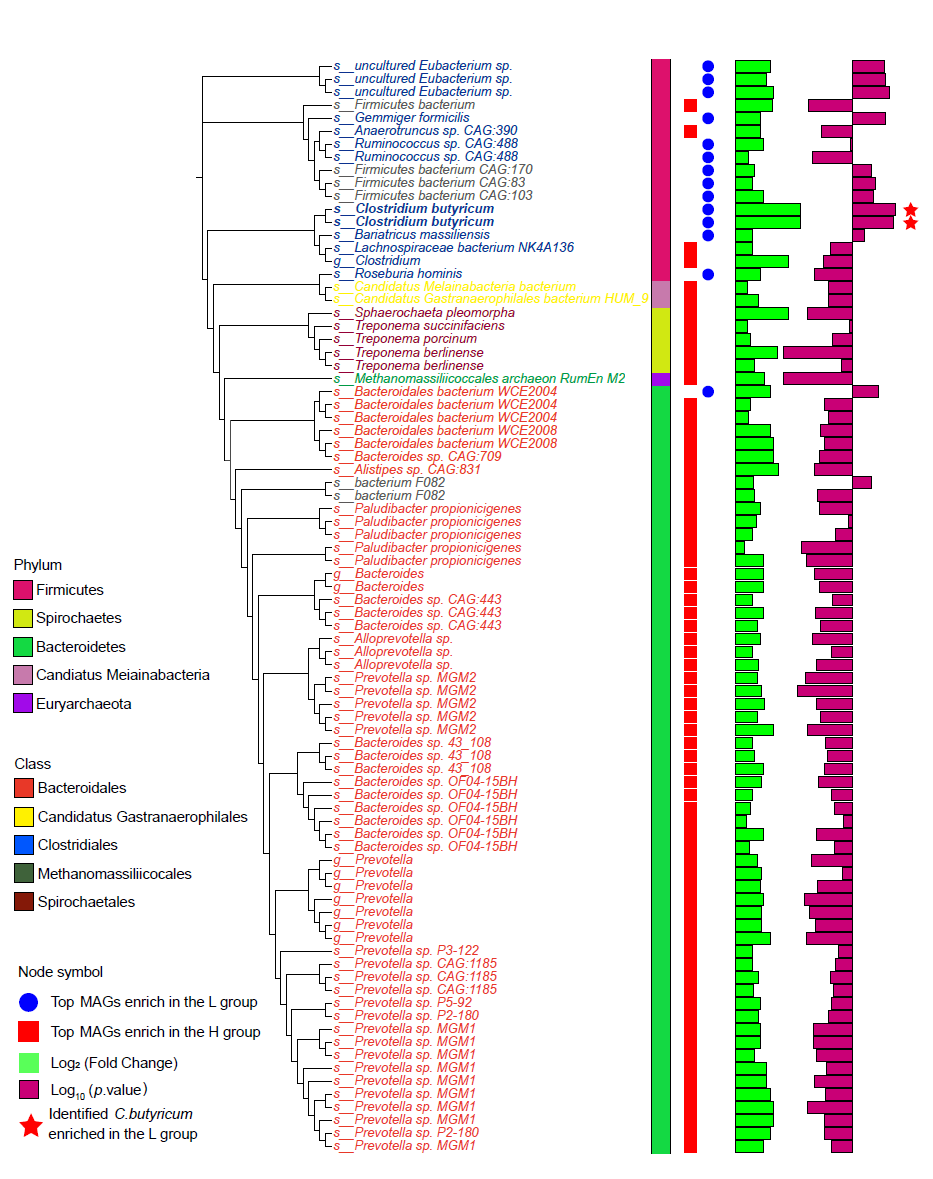
图6. 高脂肪沉积组和低脂肪沉积组中显著差异的MAGs变化
丁酸梭菌分离株可减轻肥胖小鼠的脂肪沉积并增加 GH13丰度
随后,通过小鼠干预试验评估分离的丁酸梭菌在高脂饮食诱导的肥胖小鼠中对脂肪沉积和肠道菌群的调控作用。粪便DNA的qPCR结果证实了丁酸梭菌在小鼠肠道中的成功定植。与高脂饮食的小鼠相比,丁酸梭菌显著减轻了高脂饮食导致的体重增加(图7A)。此外,丁酸梭菌干预显著减少了肥胖小鼠脂肪沉积,包括附睾、肠系、内脏和皮下脂肪(图7B)。RT-PCR分析结果显示,在丁酸梭菌干预后,脂肪组织中脂肪生成基因(尤其是Srebp-1c、Pparγ和Fasn)的mRNA水平显著下降(图7C)。且脂肪分解相关基因如Ppara和Cpt-1a,在丁酸梭菌干预后表达显著升高(图7C)。
PCoA结果显示,正常饮食的对照小鼠和高脂饮食的肥胖小鼠肠道菌群结构存在显著差异(图7D)。在门水平上,高脂饮食增加了厚壁菌门(Firmicutes)的丰度,降低了拟杆菌门(Bacteroidetes)的丰度;反之,丁酸梭菌干预后,厚壁菌门(Firmicutes)丰度有所下降,且拟杆菌门(Bacteroidetes)升高(图7D)。以上结果表明丁酸梭菌可改善高脂饮食引起的微生物失衡。重要的是,丁酸梭菌干预后显著增加了产SCFAs菌的丰度,如两歧双歧杆菌(Bifidobacterium bifidum)、假链状双歧杆菌(Bifidobacterium pseudocatenulata)和长双歧杆菌(Bifidobacterium longum)(图7E)等。此外,结肠内容物中丁酸梭菌丰度也显著上升(图7E)。CAZymes变化如图7G所示,其中肠道微生物编码的GH13丰度在丁酸梭菌干预后显著增加(图7F)。这些结果进一步支持了丁酸梭菌通过增加肠道菌群编码GH13水平,促进碳水化合物利用从而减缓宿主脂肪沉积的作用。
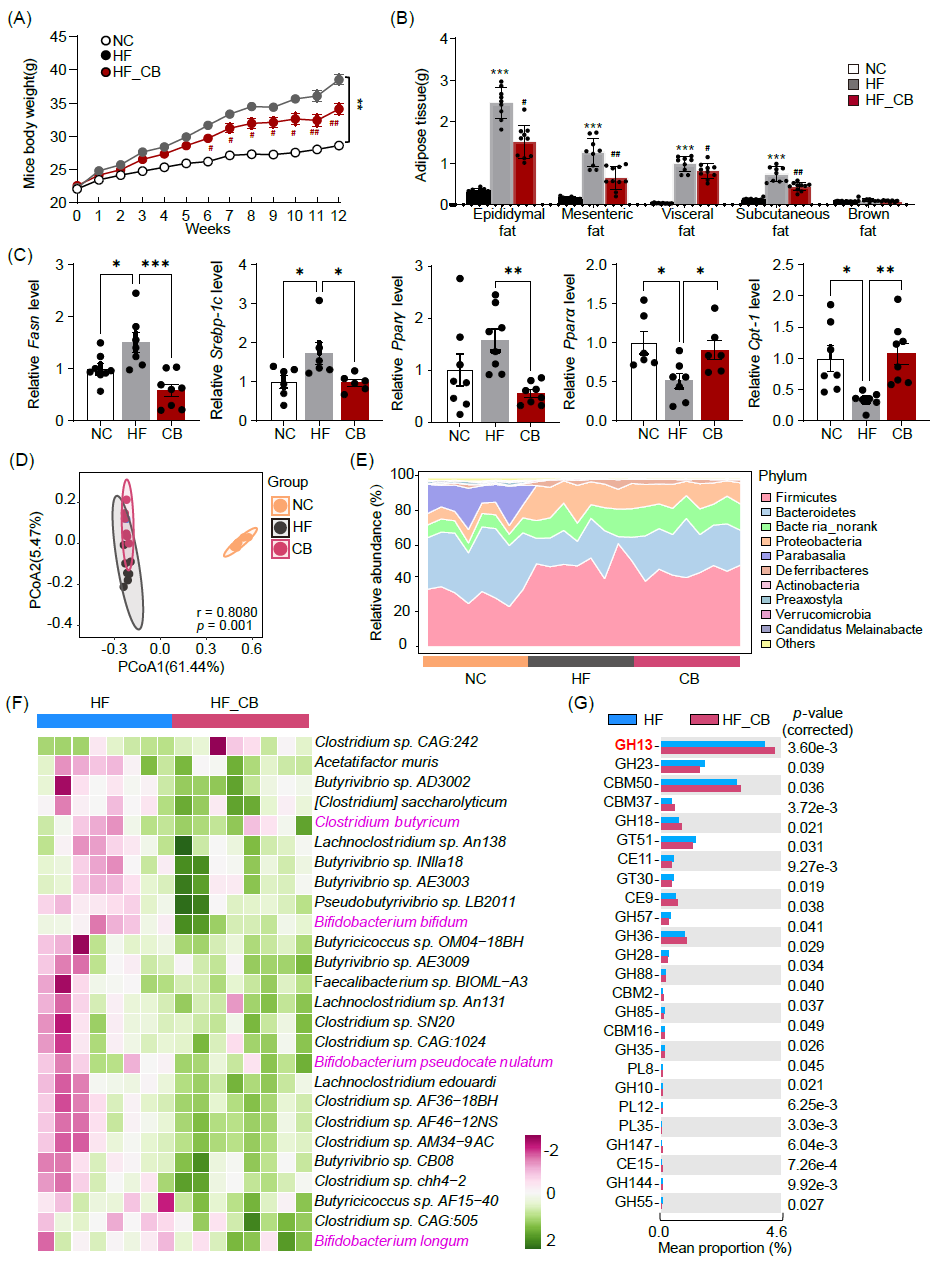
图 7. 丁酸梭菌分离株对高脂饮食诱导的肥胖小鼠脂肪沉积和肠道菌群的调控作用
(A)小鼠体重;(B)附睾、肠系、内脏、皮下和棕色脂肪组织重量;(C)皮下脂肪组织中脂肪生成和脂肪分解相关基因的表达;(D)主坐标分析显示各组微生物结构变化;(E)门水平微生物丰度变化;(F)产 SCFAs 的细菌种类的丰度变化;(G)CAZymes的差异变化。
丁酸梭菌干预减缓金华猪脂肪沉积
与对照组相比,丁酸梭菌干预后,猪的眼肌面积显著增加,平均背膘厚度和肝脏脂肪显著降低(图8A)。RT-PCR结果进一步表明,丁酸梭菌干预后,脂肪组织中Fasn和Pparγ表达显著增加,而丁酸梭菌干预组中Cpt-1的mRNA表达水平下调(图8B)。此外,PCA图揭示了对照组和丁酸梭菌干预组之间的肠道微生物群的显著差异(图8C)。在门水平上,丁酸梭菌干预显著增加了放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和螺旋菌门(Spirochaetes)的相对丰度(图8D)。相反,丁酸梭菌处理组中拟杆菌(Bacteroidetes)减少(图8D)。桑基图显示了从门到属水平上的微生物群组成变化(图8E)。值得注意的是,丁酸梭菌处理后,狭义梭菌1(Clostridium sensu stricto 1)的丰度显著增加,这与低脂肪沉积金华猪的肠道菌变化趋势相似(图8E)。更为重要的是,饲喂丁酸梭菌后,猪结肠内容物中丁酸浓度升高(图8F)。这些结果进一步支持了丁酸梭菌通过调节肠道微生物组成,对宿主脂肪沉积产生积极影响。
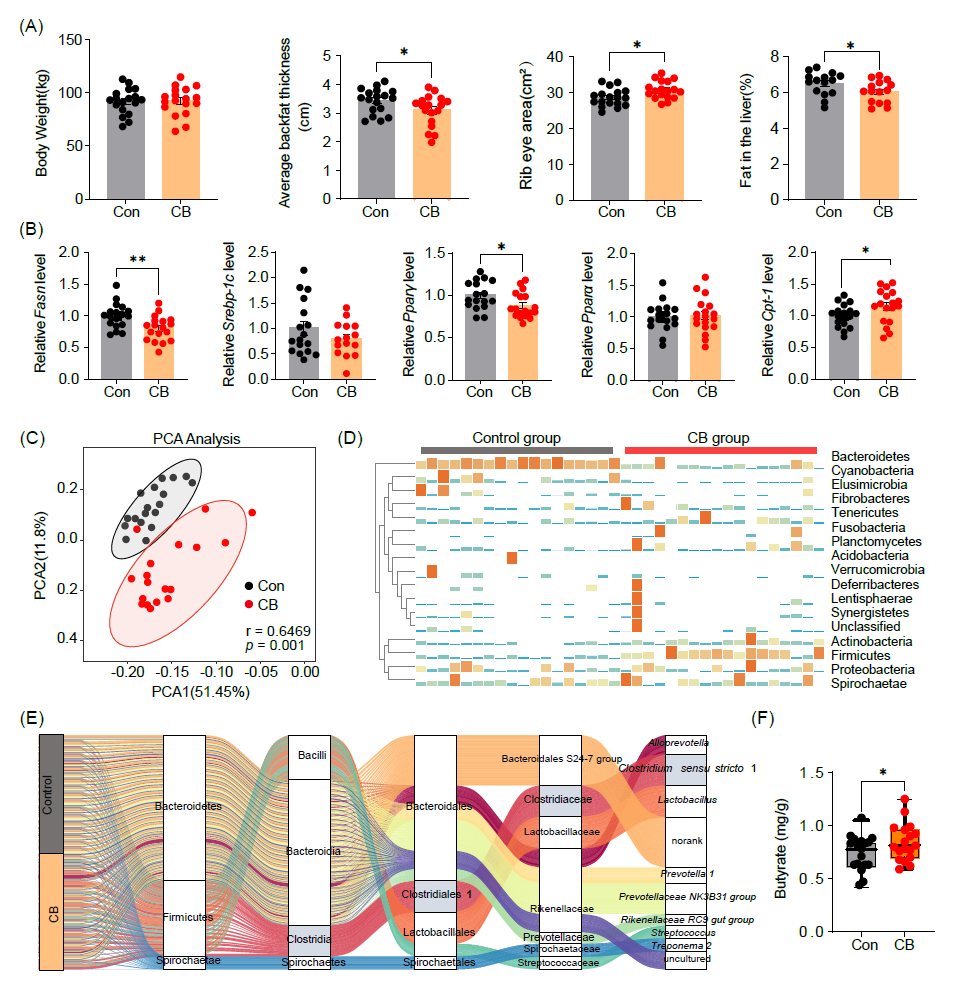
图8 丁酸梭菌干预减缓金华猪脂肪沉积
(A)表型数据,包括体重、平均背膘厚度、眼肌面积和肝脏脂肪含量;(B)猪皮下脂肪组织中脂肪生成和脂肪分解相关基因的表达;(C)主成分分析;(D)肠道菌群门水平相对丰度;(E)桑基图展示Top 10 OTUs在两组中动态变化;(F)两组结肠中的丁酸变化。
讨 论
研究表明,肠道微生物被认为是调节脂肪储存表型、消化率和生长性能的关键环境因素。在之前的研究中,我们对金华猪和丹麦长白猪(具有不同脂肪沉积表型的猪品种)的肠道微生物进行了不同肠段的比较,并揭示了肠道微生物与脂肪沉积之间的关联。通过PCA图的分析,发现不同脂肪沉积的金华猪在不同肠段的微生物组之间存在明显的差异,这表明群落的结构和组成在不同肠段发生了显著变化。
短链脂肪酸,尤其是丁酸,在连接微生物功能和多种生物效应方面发挥着关键作用。丁酸被认为是结肠上皮的重要能源。此前的研究表明,在猪中通过膳食添加丁酸钠,特别是在断奶后,可以提高出生后最初几个月以及随后几个月的生长性能。此外,口服SCFA已被证明可以通过减少脂肪生成和增强脂肪分解来减少断奶猪的脂肪沉积。在本研究中,我们发现,在脂肪沉积较低的金华猪中存在较高水平的SCFAs,尤其是丁酸,这进一步支持了SCFA在调节脂肪储存中的重要作用。值得关注的是,两个丁酸激酶途径酶的基因(ptb和buk)在L组肥猪的结肠中显示出较高水平。这不仅支持了buk和ptb在丁酸形成中的关键作用,而且也解释了我们在金华猪结肠中观察到的丁酸水平显著增加的现象。此外,微生物丰度与SCFAs水平之间的相关性揭示了丁酸与Clostridium sensu stricto 1之间更为显著的相关性,表明L组中富集的产丁酸菌可能会影响宿主的脂肪沉积。
我们的研究进一步强调了丁酸梭菌可作为低体脂沉积金华猪中的代表性菌株。丁酸梭菌是一种产丁酸的革兰氏阳性专性厌氧细菌,属于梭菌簇 I,常见于动物和人类的肠道中,并被广泛用作益生菌。除了对短链脂肪酸生产的积极影响之外,大量的研究还证明丁酸梭菌对动物的生长性能、营养利用和肠道健康具有积极的影响。此外,有报道显示,丁酸梭菌能够调节动物的脂质代谢,包括减少三酰甘油(TG)的合成、促进脂肪酸氧化,并影响肠道微生物群和胆汁酸特征。这些研究结果得到了小鼠实验的进一步支持,该实验证明了丁酸梭菌分离株能够减轻高脂饮食诱导的脂肪沉积。此外,与丁酸梭菌干预相关的脂肪沉积减少可能部分归因于脂肪生成的减少和脂肪酸β-氧化的增强,主要表现为Ppara基因的显著降低以及Cpt-1a基因的mRNA表达水平的显著提高。这些发现强调了丁酸梭菌可能是参与猪脂肪沉积的核心菌种。
结肠微生物组编码多种碳水化合物酶,使其能够降解各种碳水化合物。研究表明,低脂肪沉积猪和高脂肪沉积猪之间的CAZymes丰度存在显著差异,低脂肪沉积猪中参与半乳糖、木聚糖和甘露糖代谢的CAZymes表现出更高的富集度。在我们的研究中,CAZymes家族包含各种分子酶功能,两组CAZymes的多样性反映了碳水化合物降解能力差异。越来越多的证据表明丁酸梭菌与参与碳水化合物降解的酶之间存在紧密联系。我们在丁酸梭菌菌株中鉴定出了多种CAZyme家族。例如,C. butyricum占CBM50序列的8.15%,它与能够分解几丁质或肽聚糖的几种GH紧密相连。在丁酸梭菌菌株中发现的另一个重要的CAZyme基团是CE4家族,它在木聚糖和低聚木糖的脱乙酰化中发挥着至关重要的作用。CE4酶在丁酸梭菌中的普遍存在表明该菌株具有有效修饰和利用这些复杂碳水化合物的能力。此外,我们的分析揭示了糖基水解酶GH13的显著丰度,特别是在L组中。GH13属于α-淀粉酶家族,是负责淀粉降解的主要酶。脂肪沉积较低的猪体内GH13的含量增加表明,表明其肠道微生物更容易消化分解不溶性淀粉,从而提高饲料利用率,进一步缓解脂肪沉积。
综上,以上结论强调了丁酸梭菌与参与碳水化合物降解的多种CAZymes家族之间的复杂关系。这些结果可为了解该菌株有效分解和利用各种复杂碳水化合物(例如肽聚糖、木聚糖、淀粉等)的相关机制提供了理论基础,有助于进一步挖掘丁酸梭菌在提高碳水化合物利用率和促进动物健康方面的新应用。
方 法
动物试验1:探讨肠道微生物组与猪脂肪沉积之间的相关性
研究期间,以78头180日龄的雄性金华猪为研究对象,在中国浙江省金华市农业科学院实验农场的环境控制设施中展开研究。每个饲养圈内共有9-10头猪,它们在相似的饲养和管理条件下饲喂标准商业玉米-大豆配方饲料,含有玉米60.9%,大豆20.5%,麦麸13.5%,消化能13.21 MJ·kg−1,粗蛋白15.15%。所有动物在270日龄后被宰杀。脂肪和肌肉厚度数据通过Autofom超声设备测量,计算得到LMP值,用作评估肠道微生物组在猪肥胖中的作用的指标。随后选取了14个具有极端表型值的猪粪便样本进行16S rRNA和宏基因组测序,分为高脂肪沉积组(H组,n=7,LMP值为45.12±0.05)和低脂肪沉积组(L组,n=7,LMP值为51.23±0.07)。
动物试验2:验证丁酸梭菌分离株对高脂饮食诱导的肥胖小鼠脂肪沉积和肠道菌群的影响
选取8周龄的雄性C57BL/6J小鼠为研究对象,饲养在温度受控(22±2℃)房间中,12小时的暗光循环。在适应环境1周后,将其分为3组(n = 8/组),并按以下方式饲养12周:(1)对照组(NC组,饲喂普通饲料);(2)高脂肪饮食组(HF组,饲喂60%脂肪饲料);(3)丁酸梭菌干预组(HF_CB组,每天灌胃10−8 CFU丁酸梭菌200 μL)。
动物试验3:验证丁酸梭菌对猪体脂沉积的调控作用
鉴于直接从猪身上分离的菌种在用于养猪生产之前需要进行安全性验证,我们采用商品化的猪源丁酸梭菌来探究其对金华猪脂肪沉积的影响。以36头金华猪(180日龄)为研究对象,根据体重分为两组(n = 18/组):1)对照组(Con组):饲喂普通饲料;2)丁酸梭菌组(CB组):金华猪按10−10 CFU/kg体重配合日粮给予,自由饮水、采食,连续12周。饲养条件同试验1。
宏基因组测序分析
从14个样本(动物试验1的H组和L组的结肠内容物)以及16个肥胖小鼠样本中提取高质量DNA,并构建了插入大小为350 bp的宏基因组文库。使用Trimmomatic(v0.32)对原始读数进行过滤,去除了(i)长度小于50 bp的读数,(ii)含有简并碱基(N)的读数,以及(iii)定义为初始20个核苷酸的序列的所有重复序列相同且在最短读取的整个长度中总体同一性相似性 > 97%的数据。Megahit(v1.2.9)用于将这些清理后的读段组装成重叠群,而Prodigal则用于从重叠群中进行基因预测并获取每个宏基因组的基因图谱。通过CD-HIT对非冗余基因集进行聚类(95%的同一性和90%的覆盖率)。
基于这些基因图谱,使用Salmon将每个宏基因组的清理读段(仅保留理论上属于原核生物的读段)映射到清理的非冗余基因图谱,从而得到这些非冗余基因的TPM(每百万读段的转录本)丰度。每个宏基因组都有一个冗余基因图谱。最后,通过Diamond将这些基因与NCBI中的NR数据库进行对比,并得到了每个宏基因组中这些基因的假定分类单元分配。
宏基因组测序的分箱阶段采用了Metabat2。通过BWA软件将clean read映射到最终的非冗余高质量MAG,并计算了MAG的相对丰度和表达量。使用CheckM(v1.0.12)对回收的每个MAG进行质量评估,其合并方法用于合并来自相同微生物种群的箱,以提高完整性(≥ 80%)并减少污染(≤ 10%)。经过两步建箱后,选择了1,288个MAG(完整性 ≥ 80%且污染 ≤ 10%)进行进一步分析。快速全基因组平均核苷酸同一性(ANI)用于计算每个MAG之间的平均核苷酸同一性(ANI ≥ 95%)。使用基因组分类数据库工具包(GTDB-Tk)(v2.1)对MAG进行分类注释。最后,通过PhyloPhlAn(v3.0.51)构建系统发育树,并通过iTOL(v5.6.2)进行可视化。
功能注释
通过BLASTP对KEGG数据库(2021.07;https://www.genome.jp/kegg/)进行操作,使用e值为10-5来获取KEGG直向同源物(KO)对“非冗余”基因目录进行功能注释。采用自定义的Perl脚本获取每个宏基因组KO途径的丰度PPM(每百万序列一个KO途径分配的序列)。LEfSe用于鉴定高脂肪沉积猪和低脂肪沉积猪之间KEGG通路丰度的显著差异,标准为LDA大于3且p值小于0.05。对CAZymes进行注释使用HMMER,将蛋白质序列与CAZyme数据库下载的CAZymes家族的HMM库中的条目进行匹配(http://www.cazy.org)。
采用Circos根据带注释的CAZyme家族的PPM绘制细菌分类群对CAZyme家族的贡献。通过Spearman相关分析进行相关性分析,并使用Gephi(v 0.9.1)可视化CAZyme家族之间的相关网络。CAZyme家族在高脂肪沉积组和低脂肪沉积组之间的显著性通过STAMP软件提供的Welch t检验和Benjamini-Hochberg FDR校正来确定。最终的热图由TBtools软件生成。
统计分析
数据呈现为平均值±SEM。针对表型差异的显著性进行了 t 检验或单向方差分析。为了评估各组之间的差异,采用了基于Bray-Curtis排序的主坐标分析(PCoA)图。相似性分析(ANOSIM)和排列多元方差分析(PERMANOVA)则通过 R vegan 包(v 2.5.4)进行,以检测组水平的显著性差异。生物信息分析利用了OmicStudio工具(https://www.omicstudio.cn/tool)和在线软件TUTU分析平台(https://www.cloudtutu.com/)。
代码和数据可用性
16S rRNA 和宏基因组测序数据已提交至 NCBI 序列读取存档 (SRA)数据库,研究登录号为 PRJNA765142 (https://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA765142)、PRJNA766255 (https ://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA766255)和 PRJNA761907 (https://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA761907)。所有的补充材料(文本、图、表、中文翻译版本或视频)也可从线上获取。
引文格式:
Ma, Lingyan, Shiyu Tao, Tongxing Song, Wentao Lyu, Ying Li, Wen Wang, Qicheng Shen, et al. 2024. “Clostridium butyricum and Carbohydrate Active Enzymes Contribute to the Reduced Fat Deposition in Pigs.” iMeta e160. https://doi.org/10.1002/imt2.160
-
点赞 (0人)
- 收藏 (0人)



